この記事では、登録販売者試験の第5章で出題される問題のうち数字でひっかけてくる部分を集めました。数字だけがまとめられている記事は見当たらなかったので、ぜひご活用ください。
第5章もいくつかに分けて書いていきます。今回は2つ目です。
数字部分は試験の直前に覚えると、頭に残りやすいので、試験が近づいてきたら確認するのがおすすめです。
この記事で扱う範囲は以下の通りです。穴埋めしながら読み進んでいくと理解できるような構成にしています。ぜひ勉強にお役立てください。
Ⅱ医薬品の安全対策
・医薬品・医療機器等安全性情報報告制度
・企業からの副作用等の報告制度
・別表5-4企業からの副作用等の報告
医薬品・医療機器等安全性情報報告制度
本制度は、1967年3月より、約( )の医療機関をモニター施設に指定して、厚生省(当時)が直接副作用報告を受ける「医薬品副作用モニター制度」としてスタートした。
・本制度は、1967年3月より、約3000の医療機関をモニター施設に指定して、厚生省(当時)が直接副作用報告を受ける「医薬品副作用モニター制度」としてスタートした。
企業からの副作用等の報告制度
・一般用医薬品に関しても、承認後の調査が製造販売業者等に求められており、副作用等の発現状況等の収集・評価を通じて、承認後の安全対策につなげている。
具体的には既存の医薬品と明らかに異なる有効成分が配合されたものについては、( )年を超えない範囲で厚生労働大臣が承認時に定める一定期間(概ね( )年)、承認後の使用成績等を製造販売業者等が集積し、厚生労働省へ提出する制度(再審査制度)が適用される。
また、医療用医薬品で使用されていた有効成分を一般用医薬品で初めて配合したものについては、承認条件として承認後の一定期間(概ね( )年)、安全性に関する調査及び調査結果の報告が求められている。要指導医薬品は、上記と同様に調査結果の報告が求められている。
具体的には既存の医薬品と明らかに異なる有効成分が配合されたものについては、10年を超えない範囲で厚生労働大臣が承認時に定める一定期間(概ね8年)、承認後の使用成績等を製造販売業者等が集積し、厚生労働省へ提出する制度(再審査制度)が適用される。
また、医療用医薬品で使用されていた有効成分を一般用医薬品で初めて配合したものについては、承認条件として承認後の一定期間(概ね3年)、安全性に関する調査及び調査結果の報告が求められている。要指導医薬品は、上記と同様に調査結果の報告が求められている。
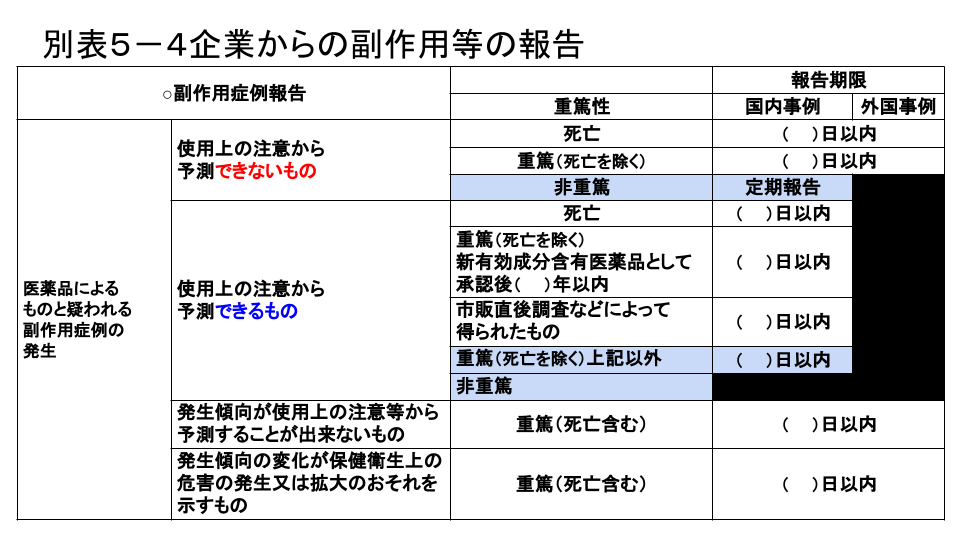
別表5-4企業からの副作用等の報告
こちらは表の内容がよく出題されます。覚えるときは例外の30日以内からがおすすめです。表の穴埋めはできても、文で聞かれると途端に解けなくなってしまうことがあるので、過去問を解きながら確認してください。



以上が登録販売者試験第5章の数字のひっかけ問題攻略のポイント2でした。他の章の数字まとめも今後作成していきますので、ぜひ勉強にお役立てください。
試験問題作成に関する手引き(令和5年4月)(厚生労働省)





コメント